呼吸器外科の基礎研究
肺癌
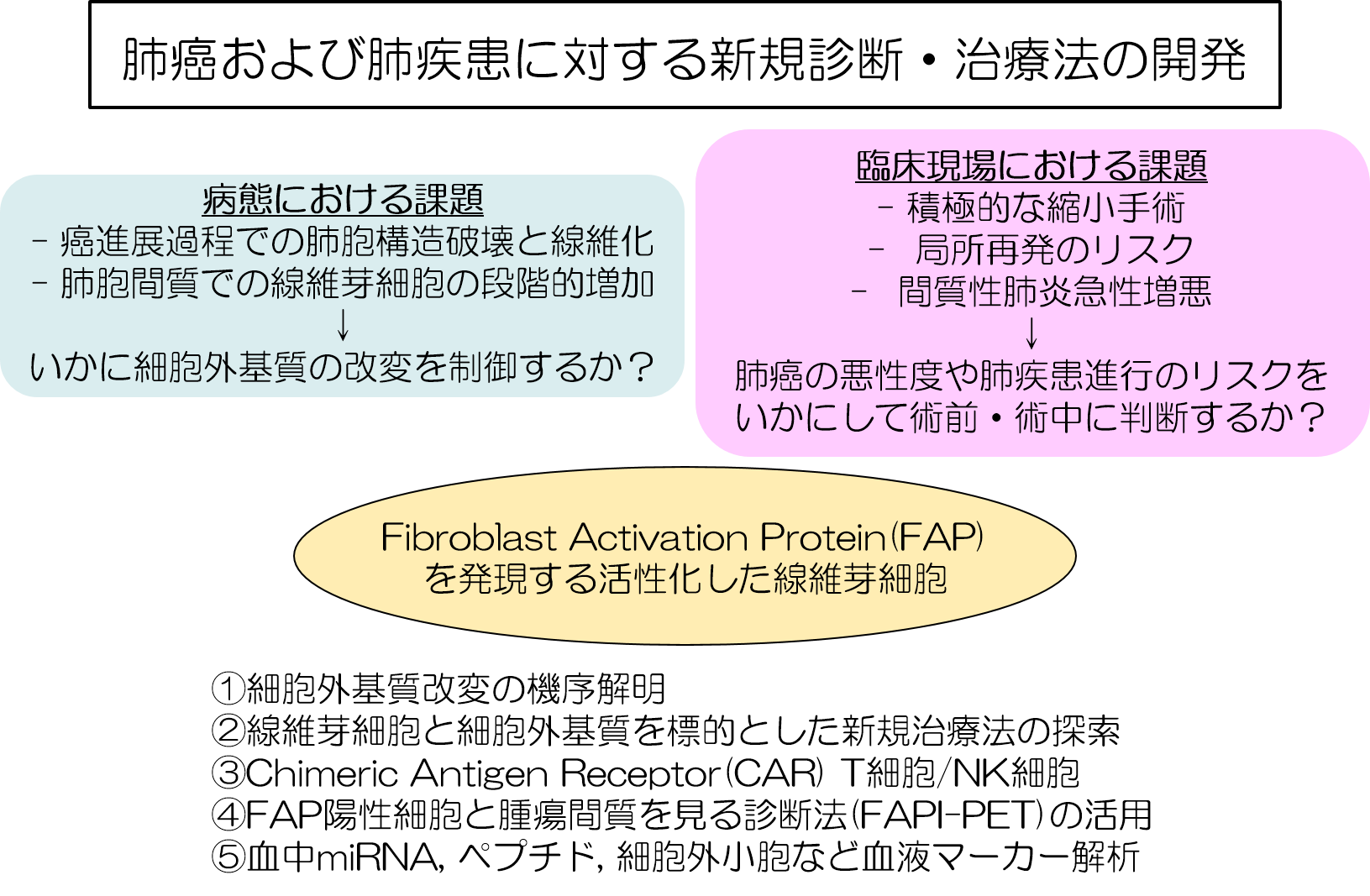
(1)癌周囲微小環境を標的とした肺癌治療の開発
日本人の死因として肺癌の占める割合は上昇傾向が著しく、このような難治固形癌に対する治療の開発は急務と考えています。癌細胞と周囲の間質細胞や細胞外基質のクロストークを解析し、肺癌周囲微小環境を標的とした肺癌治療を考案することを目的として、研究を行っています。薬剤耐性を生じやすい癌細胞に比較して、間質細胞や間質成分を標的とした場合には治療抵抗性を生じにくいと予測され、肺癌周囲微小環境を標的とした固形癌治療によって既存の癌治療に多大な相乗効果を見込めると期待されています。
腫瘍組織には癌細胞に加えて炎症細胞、免疫細胞のほか、血管・リンパ管の構成細胞、線維芽細胞や炎症細胞、またコラーゲンなどの細胞外基質が存在し、腫瘍微小環境を構築しています。これらの細胞や間質成分は癌細胞の生存・増殖を制御し、さらには癌浸潤・転移に関連しており、癌の悪性化にきわめて重要な役割を果たしています。腫瘍周囲の微小環境は癌幹細胞の生存・分裂のニッチとして働き、癌再発の中心的な機構であると考えられています。
我々は、癌微小環境の機能調節に重要な役割を果たしている上皮間葉転換EMT (Epithelial Mesenchymal Transition)に注目し、癌周囲間質に含まれるEGF、FGF、KGFやTGF-βなどの増殖因子やコラーゲンから誘導されるEMTシグナル伝達経路について報告してきました。EMTとは、上皮細胞が上皮としての形質を失い、線維芽細胞などの間葉系の形質を獲得する現象であり、間葉系の形質を得た癌細胞は遊走能を獲得し、浸潤、転移を起こします(図1)。細胞や動物実験を用いて、EMTシグナルを制御することで、癌細胞の浸潤能、転移能を低下させることを証明した(図2~3)。さらに、抗癌剤や放射線に肺癌細胞長期に暴露するとEMTが誘導され、癌幹細胞様形質を獲得する一方、EMTによって抗癌剤や放射線への耐性化が誘導されることを報告しました(図4)。EMTが癌の進展だけでなく、癌幹細胞様形質を獲得することで治療抵抗性においても重要な役割を果たしていることがわかります。
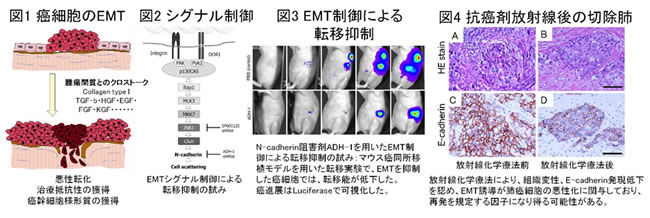
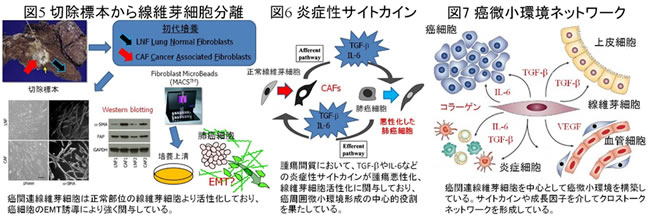
癌周囲に存在する線維芽細胞は正常肺部の線維芽細胞に比して活性化しており、癌細胞のEMT誘導に強く寄与していることを示した(図5)。腫瘍間質におけるEMT誘導にIL-6などの炎症性サイトカインが関与し、TGF-βと相乗的に作用し腫瘍悪性化、治療抵抗性に適した癌周囲微小環境へ変化していると考えられます。したがって、この腫瘍悪性化に関与するサイトカインループを制御することで固形癌治療だけでなく癌幹細胞様形質獲得を阻害し治療抵抗性の克服につながる可能性を示しました。線維芽細胞や炎症細胞を中心とした癌周囲微小環境の構築のメカニズムを解明することで、新たな癌治療の開発につなげていきたいと考えています(図7)。
(2)肺癌および肺疾患に対する新規診断・治療法の開発
(3)胸腺腫・胸腺癌に関する悪性化メカニズムの解明および新規治療法の開発
胸腺上皮系腫瘍(胸腺腫・胸腺癌)は稀少疾患であり、その腫瘍学的特性や進展メカニズムには未解明な点が多く残されています。当教室ではこれまで、マウスモデルや外科手術検体を用いた研究を通じて、アクチニン4(ACTN4)という細胞骨格関連タンパク質が胸腺腫瘍の播種や浸潤に関与していることを明らかにしてきました。
ACTN4はアクチン線維の架橋や細胞運動の制御に関与する分子であり、がんの浸潤・転移において中心的な役割を果たすことが知られています。近年、当教室はACTN4がβ-catenin/Slug経路を介して胸腺上皮系腫瘍の悪性形質に関与することを報告しました(H. Nagataら. Cancer Sci. 2024;115(11):3636–3647)。
この研究では、ヒト胸腺腫瘍検体においてACTN4発現が高い症例は、浸潤・播種を伴う高悪性度の傾向を示すことを明らかにするとともに、ACTN4を過剰発現させたマウス由来腫瘍細胞を用いたin vivoモデルにおいても、胸腔内播種の促進や局所浸潤の増強が観察されました。また、ACTN4の発現が細胞接着分子の発現抑制や、上皮間葉転換(EMT)に関与する転写因子Slugの発現上昇と関連しており、腫瘍細胞の可動性・浸潤性の増強に関与する分子機構が示唆されました。
今後も、ACTN4を中心とした胸腺上皮系腫瘍の悪性化機構のさらなる解明を進めるとともに、その分子制御によって他臓器浸潤や播種を抑制し、外科的完全切除率の向上および再発防止を目指す新たな治療戦略の開発に取り組んでまいります。




(4)外科切除標本を用いた個別化治療実現のための予後・治療効果予測因子の解析と展望
個別化治療の実現における課題は、治療成績の向上、毒性軽減であり、切除組織を利用した多数のマーカーが報告されています。最近では、EGFR変異をはじめとするドライバー遺伝子変異はいずれの役割をも果たす標的と考えられ、実際に臨床の場で利用されています。しかし、同じ個体でも癌の性質は同一ではなく、進展とともに変化することが知られ、真の予後因子を明らかにするためには癌悪性度の経時的変化を知る必要があります。
切除標本から癌細胞を培養する新しい方法(CTOS: cancer tissue-originated spheroid法)によって、癌組織の中の癌細胞をもとの性質を失わずに安定して試験管の中で純粋培養することができます。
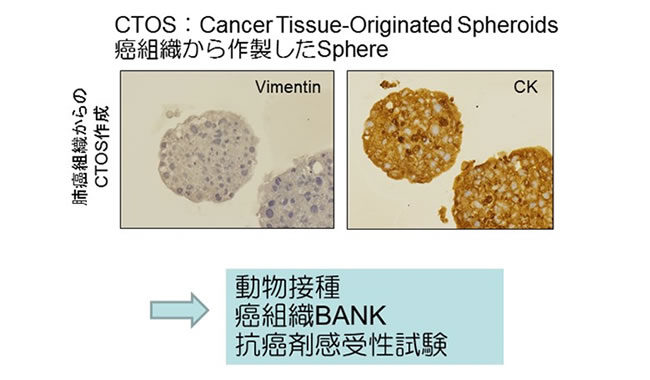
CTOS法を用いると、細胞外基質内で三次元構造が観察され、さらに免疫不全マウスへ皮下移植すると由来肺癌にきわめて類似する腫瘍を形成します。また、CTOSを利用することでより詳細な治療感受性試験が可能になります。
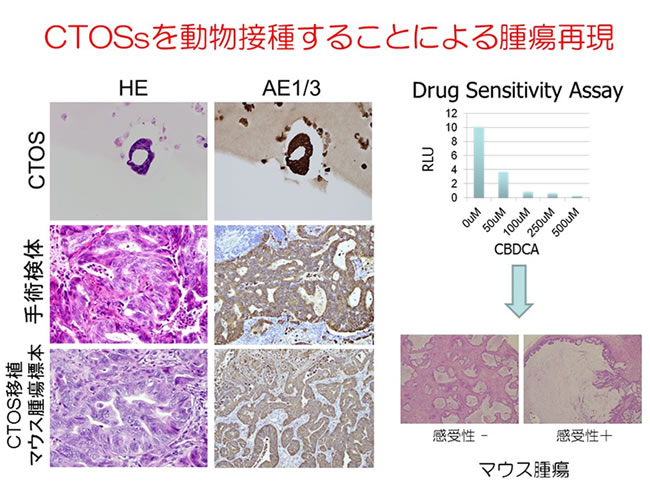 外科医は手術によって治療的切除だけでなく大きな腫瘍組織を採取できる。肺癌や微小環境の動的変化を明らかにすることで個別化医療につながる可能性があり、個々の切除標本から癌の多様性を反映するモデルを考案することが重要であると考えています。
外科医は手術によって治療的切除だけでなく大きな腫瘍組織を採取できる。肺癌や微小環境の動的変化を明らかにすることで個別化医療につながる可能性があり、個々の切除標本から癌の多様性を反映するモデルを考案することが重要であると考えています。
肺移植
ラット肺移植モデルにおけるカフテクニック
呼吸器外科の前身である大阪大学第1外科肺・縦隔研究室時代の1989年にカフテクニックを用いたラット肺移植モデルを開発しました。移植肺の血管と気管支にカフと呼ばれる、袖口のようなものを装着することにより、血管・気管支を縫合することなく、ラット肺移植ができる方法です。この方法は現在でも「Mizuta’s model」として、世界のラット肺移植を用いた研究の基本になっており、臓器移植動物実験モデルの教科書にも記載されています。

肺移植における虚血再灌流肺障害に対する新規治療法の開発
肺移植は終末期肺疾患に対する外科治療として本邦でも確立された治療法であるが、その治療成績は他の臓器移植と比較して不良であり、その改善が急務である。虚血再灌流肺傷害は肺移植術後急性期の死亡原因第1位であるPrimary Graft Dysfunction(PGD)の発症に大きく関わることが知られているが、有効な制御法は確立されていないのが現状である。
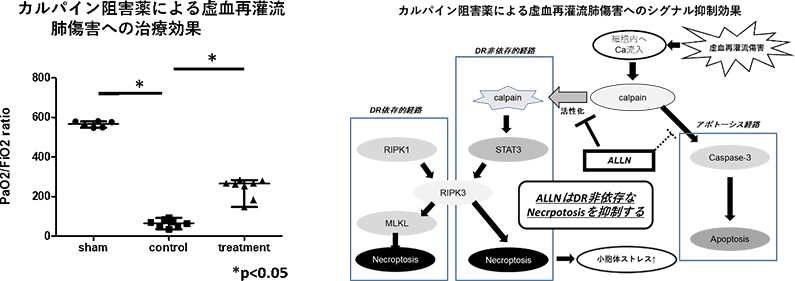
本学外科学講座では、臓器保存に関するさまざまな基礎研究を行ってきた。肺移植領域では、長時間冷保存による虚血再灌流障害に対する治療法を開発することを目的に、長時間の虚血で誘発されるネクロプトーシスを抑制する経路を見出し報告した1)。つづく研究として、カルパイン阻害薬を冷保存中に添加することで、デスレセプター非依存的経路を介してネクロプトーシスを抑制し、虚血再灌流障害に対する改善効果を示すことを報告した2)(下図)。
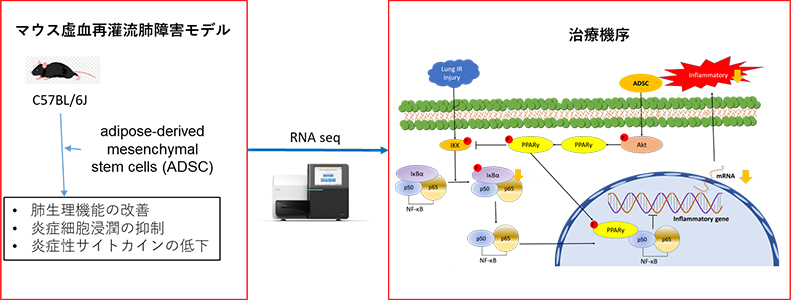
細胞死に関する研究と並行して、脂肪組織由来間葉系幹細胞 (adipose tissue-derived stromal cell;ADSCs) による虚血再灌流肺障害治療への応用に関する研究も行っている。ADSCsは多くのサイトカインや増殖因子を分泌し、マウス肺門モデルによる虚血再灌流肺障害をおこしたマウスへ経静脈的にADSCsを投与することにより、肺障害を改善することを報告した3)。このように、当科では、小動物肺移植モデルを用いて、新規化合物や細胞療法を活用した肺移植後虚血再灌流肺障害に対する新たな治療法の開発に取り組んでいる。
現在、進行している基礎研究として本邦における心停止ドナーからの臓器移植開始をめざした研究を進行している。具体的には“小動物を用いたDCDモデルの確立と細胞死の抑制による治療効果の検証”というテーマで研究をすすめている。本研究の問いは、“DCD肺移植の過程で起こりうる臓器機能障害を抑制し、安全に肺移植をできるか?”、である。この問いに対して検討すべく 、現在欧米でDCDの主体であるcontrolled DCDをシミュレートしたラット肺移植モデルを確立している。予定する動物実験のタイムコースは下図に示す。再灌流2時間後に動物を犠牲死させ、血液ガス解析によるガス交換能評価やネクロプトーシス経路の推移を調べるためのウェスタンブロットや病理所見の比較を行う。
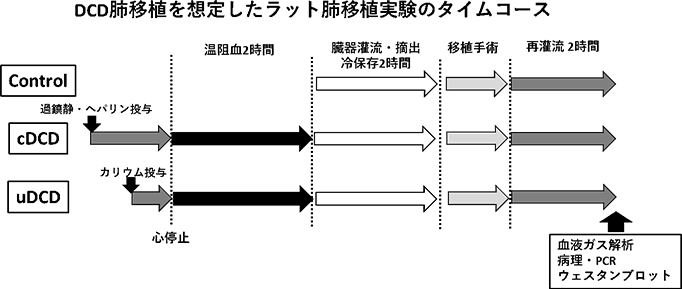
先述の研究を達成するため、① DCDの過程でどのようにネクロプトーシスの経路が活性化するのかを解明するため各タイミングにおけるサンプルを解析する、② 抗ネクロプトーシス薬の投与(Nec-1, ALLNが候補)によりDCDの過程で生じるグラフト機能障害に対する治療効果を有するか解析する、の2点を中心に研究を進める。これらの実験解析をとおして、治療介入方法(還流保存液への添加・レシピエントへの投与)、投与量など条件検討を行い、将来の臨床応用を目指したトランスレーショナルリサーチとしてその治療効果を明らかにする。
- Kanou T, Ohsumi A, Kim H, et al. Inhibition of regulated necrosis attenuates receptor-interacting protein kinase 1-mediated ischemia-reperfusion injury after lung transplantation.J Heart Lung Transplant. 2018 Oct;37(10):1261-1270.
- Matsui Y, Kanou T, Matsui T, et al. Protective Effect of Calpain Inhibition During Cold Ischemia on Ischemia-reperfusion injury after lung transplantation.Transplantation. 2023 Sep 1;107(9):1945-1954.
- Miyashita Y, Kanou T, Fukui E, et al. A novel peroxisome proliferator-activated receptor gamma/nuclear factor-kappa B activation pathway is involved in the protective effect of adipose-derived mesenchymal stem cells against ischemia-reperfusion lung injury.Transplant Proc. 2024 Mar;56(2):369-379.
肺再生
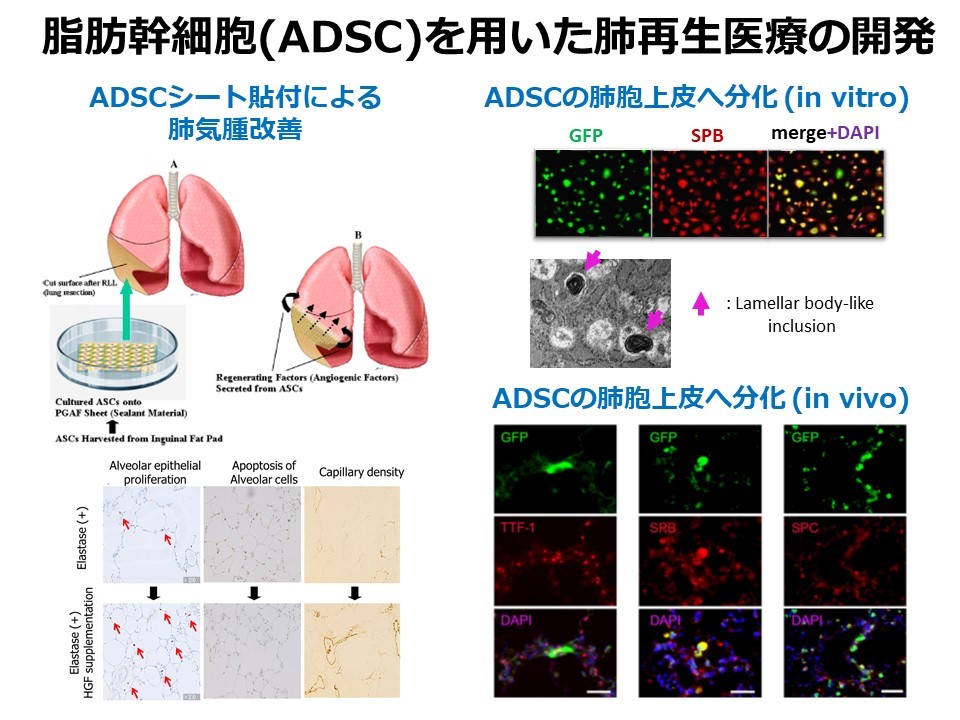
脂肪幹細胞を用いた肺再生医療の開発
呼吸不全の状態が長期に続くものは慢性呼吸不全といわれ、その中では慢性閉塞性肺疾患(COPD)が約半数を占めます。近年、成人肺でも解剖学的、生理学的に改善が認められることが報告され、肺実質の再生が可能であることが示唆されました。我々は、慢性呼吸不全に対する治療手段の可能性の一つとして、HGFに注目しCOPD動物モデルを用いてHGFの外的補充による肺気腫の病態改善の可能性を示してきました。さらに、肺気腫モデルに対する脂肪組織由来幹細胞(ADSC)の投与により、肺における内因性HGFの持続的な増加が得られました。肺切除とともにADSCシートを手術部位に貼付することで、ADSCから分泌されたHGFにより肺胞が再生することを報告しました。またADSCは適切な分化誘導法によってⅡ型肺胞上皮へ分化することを示し、肺損傷修復の過程で細胞供給源になる可能性を明らかにしました。図はGFP-ADSCが肺胞上皮マーカーをin vitroでもin vivoでも発現していることを示しています。今後、肺固有の成長因子、幹細胞の同定に加え、遺伝子導入といった再生因子の補充法、間葉系幹細胞を用いた細胞治療、そして肺自体を作りだす生体組織工学について研究していきたいと考えています。